―RAS阻害剤の開発に成功 革新的抗がん剤への発展が期待―
令和3年5月10日
国立大学法人東海国立大学機構 岐阜大学
本田諒 助教ら連合創薬医療情報研究科のグループの 研究成果が「Cell Chemical Biology」に掲載 ―RAS阻害剤の開発に成功 革新的抗がん剤への発展が期待―
岐阜大学大学院連合創薬医療情報研究科 本田諒 助教、赤尾幸博 特任教授、上田浩 教授らの研究グループは、RASタンパク質(注1)を阻害する新規薬剤の開発に成功しました。RASタンパク質は約30%のがんで活性型に変異していますが、これまでの技術ではRAS阻害剤を設計することが困難でした。本研究グループは細胞膜透過性タンパク質(注2)というユニークな分子を多数合成し、この中からRAS阻害剤を見出すことに成功しました。本剤は革新的な抗がん剤に発展することが期待されます。
本研究成果は、2021年5月8日(土)にCell Chemical Biology誌のオンライン版で発表されました。
【発表のポイント】
・RASタンパク質は約30%のがんで活性型に変異しているため、RAS阻害剤の開発は多数のがんを抑制する革新的な抗がん剤に発展することが期待されています。
・しかし、RASタンパク質は従来の技術では阻害剤を設計することが難しい性質をしているため、これまで有効なRAS阻害剤は開発されませんでした。
・本研究では、今まで注目されていなかった「細胞膜透過性タンパク質」という分子を多数合成することで、新規RAS阻害剤を開発することに成功しました。
・本剤を基本骨格にしてさまざまな改良を加えることで、将来的に革新的な抗がん剤に発展することが期待できます。
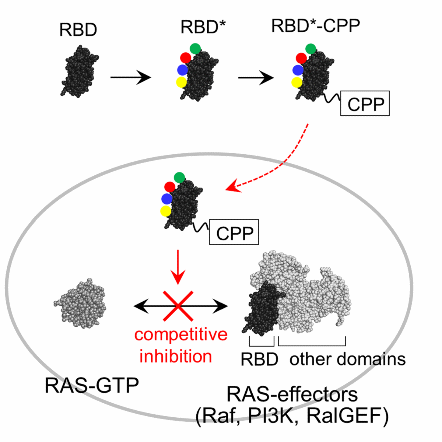
図.開発したRAS阻害剤の構造と阻害メカニズム
本剤はRAS結合ドメイン(RBD)(注3)と細胞膜透過性ペプチド(CPP)(注4)が融合した人工タンパク質です。本剤は分子量が大きいにも関わらず細胞膜を通過することができるため、細胞の中に侵入しRASと強く結合することができます。これによってRASの機能を阻害し、がんを抑制することができます。
【研究背景】
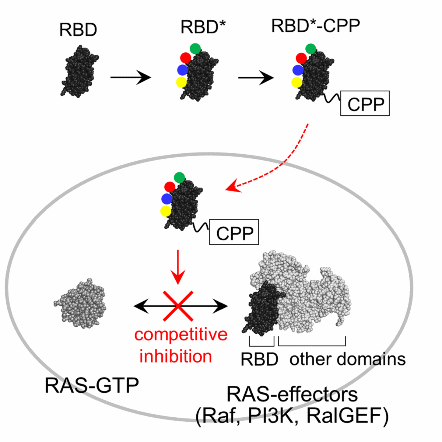
RASタンパク質は約30%のがんで活性型に変異し、がんの増殖や転移を促進する因子として機能しています。このことから、RAS阻害剤は多数のがんを抑制できる革新的な抗がん剤に発展することが期待されています。しかし、RASタンパク質の表面は円滑で小さな分子が結合できるくぼみがないため、小さい分子はRASに結合しその機能を阻害することはできません。また、大きい分子も細胞膜を通過することができないため、細胞の中にいるRASタンパク質までたどり着くことができません。このように、小さい分子も大きい分子もRAS阻害剤となることは難しく、過去30年間以上の世界規模での研究にも関わらず、いまだ有効なRAS阻害剤が開発されていないのが現状です。近年、G12Cという特定の変異型RASタンパク質を阻害する薬剤の開発が進んでいますが、その他大多数の変異型RASタンパク質を阻害する薬剤は現時点でありません。
【研究の経緯】
本田諒助教らの研究グループは特殊なタンパク質の合成や修飾を得意としているため、タンパク質を用いてRASを阻害できないかと考えました。過去の研究で「RAS結合ドメイン」というタンパク質がRASに強く結合することが示されています。しかし、RAS結合ドメインは分子量が約10,000 Daと大きすぎるため、細胞膜を通過することができず、細胞の中にいるRASにまでたどり着くことができません。そこで、本研究グループは細胞膜透過性ペプチドなどの修飾をRAS結合ドメインに加えることで、細胞膜を通過しRASにまでたどり着くよう改良を加えました(図1)。何十種類もの修飾の組み合わせを試した結果、ついに細胞膜を透過しRASを強く阻害する薬剤の開発に成功しました。
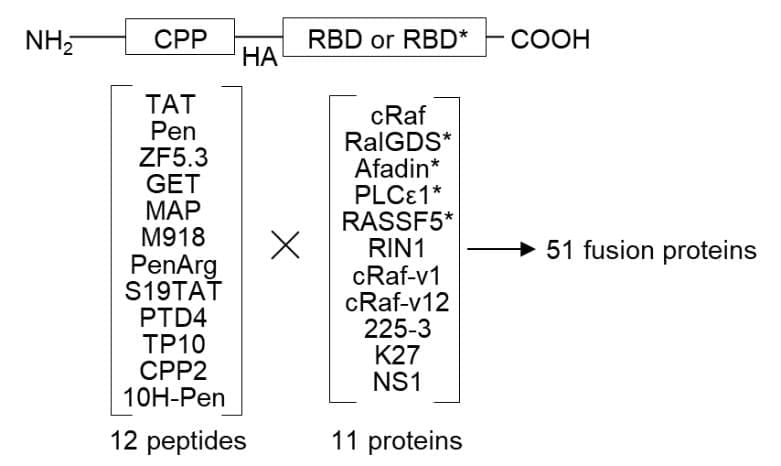
図1:合成したタンパク質の基本構造を示します。11種類のRAS結合ドメイン(RBD)と12種類の細胞膜透過性ペプチド(CPP)の計51通りの組み合わせを試しました。
【研究成果】
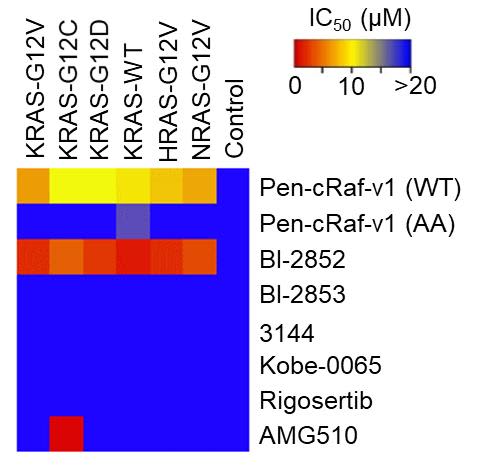
本研究で開発したRAS阻害剤は細胞膜を通過し、細胞内にいるRASに強く結合することができます。RASとの結合の解離定数(注5)は34 nMであり、これは過去に文献で報告されたどのRAS阻害剤よりも優れた値です(図2)。また、細胞モデルにおけるRAS阻害のIC50値(注6)は数µM程度であり、これも過去に報告されたRAS阻害剤以上の値です(図3)。さらに、本剤はG12C変異型RASだけでなく、G12V、G12Dなどの大多数の変異型RASも阻害することも確認しました。これは、現在臨床試験で評価されているG12C阻害剤には見られない特長です。最後に、本剤がRAS以外の標的に作用しないこと(特異性)をトランスクリプトーム解析(注7)とアラニン変異解析(注8)で確認しました。以上の結果は、本剤が強力なRAS特異的阻害剤であることを示しています。
図2:開発したRAS阻害剤とRASの結合を示すデータです。左図にあるように、本剤は活性型RAS(GTPγS結合型)にKd = 34 nMで強く結合しますが、非活性型RAS(GDP結合型)にはKd =1.9 µMと弱くしか結合しません。
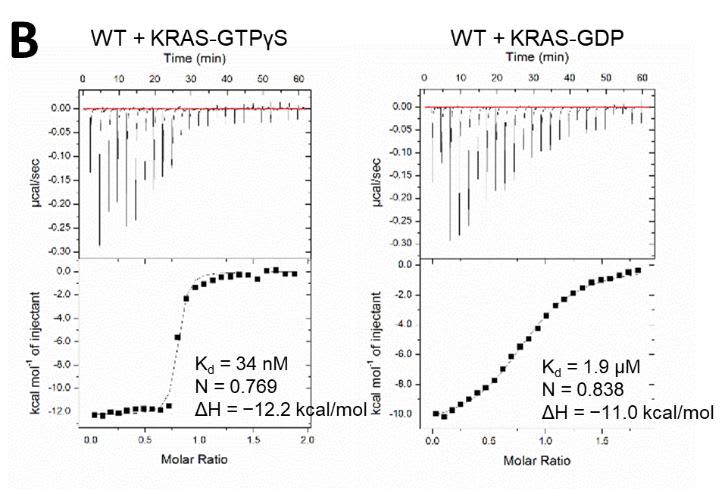
図3:本研究で開発したRAS阻害剤(Pen-cRaf-v1)と過去に報告されたRAS阻害剤を比較したデータです。本剤はG12Cだけでなく、G12VやG12Dといった変異型RASも阻害することができます。これは現在臨床試験で評価されているG12C阻害剤(AMG510)には見られない特長です。競合品としては、BI-2852という最近報告されたRAS阻害剤が本剤と同程度の活性を示しましたが、その他は本剤よりも低い活性しか示しませんでした。
【今後の展開】
本研究で開発したRAS阻害剤は細胞膜透過性タンパク質というユニークな分子であり、強いRAS阻害作用と特異性を併せ持っています。今後はマウスなどの個体モデルで本剤のRAS阻害効果を確認し、安全性試験・毒性試験を行ったのち、臨床試験でがん治療薬としての作用を評価する予定です。また、本剤を改良しRAS阻害活性や安全性を向上させる試みも行っています。
【論文情報】
雑誌名:Cell Chemical Biology
タイトル:Specific inhibition of oncogenic RAS using cell-permeable RAS-binding domains
(細胞膜透過性をもつRAS結合ドメインにより変異型RASを特異的に阻害する)
著者:Teiko Komori Nomura, Kazuki Heishima, Nobuhiko Sugito, Ryota Sugawara, Hiroshi Ueda, Akao Yukihiro, and Ryo Honda
(野村禎子、平島一輝、杉戸信彦、菅原涼太、上田浩、赤尾幸博、本田諒、すべて連合創薬所属)
DOI番号:https://doi.org/10.1016/j.chembiol.2021.04.013
論文公開URL:https://www.cell.com/cell-chemical-biology/fulltext/S2451-9456(21)00206-3
【用語解説】
(注1)RASタンパク質:もともとは細胞の増殖などの機能に関与しているタンパク質です。しかし、がんの約30%では活性型に変異しており、これががんの増殖や転移などの主原因になっています。RASの変異にはG12C、G12V、G12D、Q61Rなどさまざまなタイプがあります。
(注2)細胞膜透過性タンパク質:ふつうのタンパク質は分子量が大きすぎるため、細胞膜を通過して細胞の中に入ることができません。しかし、特殊なペプチドやリポソームなどでタンパク質を修飾すると細胞の中に入る場合があります。このような特殊なタンパク質を細胞膜透過性タンパク質と呼びます。
(注3)RAS結合ドメイン: RASのシグナル伝達に関与する「RASエフェクタータンパク質」がもつドメインです。分子量10,000Da程の大きな分子で、先行研究でRASに強く結合することが示されています。数十種類のRAS結合ドメインが知られています。
(注4)細胞膜透過性ペプチド:大きな分子の細胞膜透過性を高めるペプチドです。数10個程度のアミノ酸から成ります。数百種類の異なるアミノ酸配列の細胞膜透過性ペプチドが知られています。
(注5)解離定数:結合の強さを示す値です。小さい値ほど結合が強いことを示します。
(注6)IC50:阻害の強さを示す値です。小さい値ほど阻害作用が強いことを示します。
(注7)トランスクリプトーム解析:細胞内のすべての遺伝子転写産物(mRNA)を網羅的に解析する手法です。この手法を用いることで、細胞内のどのシグナル経路が阻害されているかがわかります。
(注8)アラニン変異解析:RAS結合ドメインの88番のアルギニンと89番のヒスチジンをアラニンに変異させる手法です。この変異によってRAS結合ドメインはRASに結合できなくなり、RAS阻害活性を失いま
す。これを実験的に証明することで、開発した阻害剤がRASに結合することでRAS阻害活性を発揮していることが証明できます。
【研究支援】
本研究は科研費(若手研究19K16828)、日立財団(第51回倉田奨励金)、東海産業技術振興財団(研究育成型・ライフイノベーション)、安田記念医学財団(若手癌研究助成)、橋渡し研究戦略的推進プログラム(A123)の支援を受けました。
【研究者プロフィール】
本田 諒(ほんだ りょう)
岐阜大学大学院連合創薬医療情報研究科
<略歴>
2015年3月 岐阜大学医学部医学科 修了
2017年11月 岐阜大学大学院連合創薬医療情報研究科 助教
2018年3月 岐阜大学大学院医学系研究科 修了 博士(医学)取得
